主要包括以下4个基本步骤:
样品制备
电泳分离
蛋白的膜转移
免疫杂交与显色――蛋白检测
溶液和试剂
1X 磷酸盐缓冲液(PBS)
Modified RIPA buffer
Tris-HCl: 50 mM, pH 7.4 ; NP-40: 1% ;Na-deoxycholate: 0.25% ;NaCl: 150mM ;EDTA: 1 mM ;PMSF: 1 mM ;Aprotinin, leupeptin, pepstatin: 1microgram/ml each ;Na3VO4: 1 mM ;NaF: 1 mM
1X SDS 样品缓冲液
62.5 mM Tris-HCl (pH 6.8 于 25°C), 2% w/v SDS, 10%甘油,50 mM DTT,0.01% w/v溴酚蓝
转移缓冲液
25 mM Tris base, 0.2 M 甘氨酸, 20%甲醇 (pH 8.3)
10X Tris缓冲盐 (TBS)
准备1L 10X TBS: 24.2 g Tris base, 80 g NaCl;用1N HCl调pH为 7.6
脱脂奶粉或BSA
甲醇
TBS/T缓冲液
1X TBS, 0.1% Tween-20
封闭缓冲液(TBS/T)
1X TBS, 0.1% Tween-20加5% w/v脱脂奶粉或BSA
一抗的稀释
1X TBS, 0.1% Tween-20 加 5% BSA (多抗)或 5%脱脂奶粉(单抗)
Note:
一般来说, BSA被推荐用于多克隆抗体,脱脂奶粉用于单克隆抗体,这样可得到较高的信噪比。抗体的稀释度参考抗体说明书或根据实验确定。
预染的蛋白质Marker,可用于监测转膜的效率
样品制备
原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。
1.培养细胞或药物处理。
2.弃培养基,用1X PBS漂洗细胞2次,去尽残留培养基。
3.加入1X SDS样品缓冲液(6-well plate, 100 ?l /w或 75 cm2 plate, 500-1000?l/瓶),刮落细胞,转移到Ep管。
注意:冰上操作。
4.超声 10~15秒剪切DNA以减低样品粘性。
5.煮沸样品5 minutes。
6.离心12000g, 5 min,取上清。
7.电泳分离:上样15?l~20 ?l 至 SDS-PAGE 胶 (10 cm x 10 cm)电泳。
如要定量检测某蛋白的表达水平,应用RIPA裂解液(1 ml per 107 cells/100mm dish/150 cm2 flask)裂解细胞,收集裂解液至离心管中,在振荡器上混匀4~15min,14000g离心15min(4℃),弃沉淀,用Bradford法或其它蛋白质测定方法测定上清中蛋白浓度以调整上样体积和上样量,进行Western杂交时还需设置内或外参照,通常用beta-actin。
注意:
一般上样20~30 ?g已足够,如待检蛋白为低丰度蛋白,可加大上样量至100?g,但电泳条带易拖尾,可制备亚细胞组份或采用更敏感的检测方法。
电泳分离(参照SDS-PAGE电泳方法)转膜杂交膜的选择是决定 Western blot 成败的重要环节。应根据杂交方案、被转移蛋白的特性以及分子大小等因素,选择合适材质、孔径和规格的杂交膜。用于Western blot 的膜主要有两种:硝酸纤维素膜(NC) 和 PVDF 膜。NC 膜是蛋白印迹实验的标准固相支持物,在低离子转移缓冲液的环境下,大多数带负电荷的蛋白质会与膜发生疏水作用而高亲和力的结合在一起,但在非离子型的去污剂作用下,结合的蛋白还可以被洗脱下来。根据被转移的蛋白分子量大小,选择不同孔径的 NC 膜。因为随着膜孔径的不断减小,膜对低分子量蛋白的结合就越牢固。通常用 0.45?m 和 0.2?m 两种规格的 NC 膜。大于 20kD 的蛋白可用 0.45?m 的膜 ,小于 20kD 的蛋白就要用 0.2?m 的膜了,如用 0.45?m 的膜就会发生“Blowthrough”的现象。PVDF 膜灵敏度、分辨率和蛋白亲和力比常规的膜要高,非常适合于低分子量蛋白的检测。但 PVDF 膜在使用之前必需用纯甲醇浸泡饱和 1-5 秒钟。蛋白质常用的转移方法主要有两种:槽式湿转和半干转移。前者操作容易,转移效率高;而后者适用于大胶的蛋白转移,所用缓冲液少。
以下为槽式湿转的操作步骤。
将胶浸于转移缓冲液中平衡 10min。
注意:
1.如检测小分子蛋白,可省略此步,因小分子蛋白容易扩散出胶。
2. 依据胶的大小剪取膜和滤纸6片,放入转移缓冲液中平衡10min。如 用 PVDF膜需用纯甲醇浸泡饱和 3-5 秒钟。
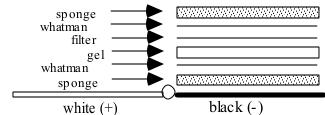
3. 装配转移三明治:海绵3 层滤纸胶膜3 层滤纸海绵,每层放好 后 ,用试管赶去气泡。切记:胶放于负极面(黑色面)。切记:胶放于负极面(黑色面)。
4.将转移槽置于冰浴中,放入三明治(黑色面对黑色面),加转移缓冲液,插上电极,100V,1h(电流约为 0.3A)。
注意:应再次检查三明治和电极是否装配正确,电源是否接通。
5. 转膜结束后,切断电源,取出杂交膜
免疫杂交与显色
1.用25 ml TBS 洗膜5min,室温,摇动。
2.置膜于25 ml 封闭缓冲液中1h, 室温,摇动。
3.15ml TBS/T洗3次(5 min/T)。
4.加入合适稀释度的一抗,室温孵育1-2h或4°C过夜,缓慢摇动。
5.15 ml TBS/T洗3次(5 min/T)。
6.加入合适稀释度的碱性磷酸酶(AP)或辣根过氧化酶(HRP)标记的二抗,室温孵育1h,缓慢摇动。
7.15 ml TBS/T洗3次(5 min/T)。
8.15 ml TBS洗1次。
9.蛋白检测(显色法或发光法,按相应试剂说明操作)。
注意事项:
1.操作中戴手套,不要用手触膜。
2.PVDF膜在甲醇中浸泡时间不要超过5秒。
3.如检测小于20kD的蛋白应用0.2?m的膜,并可省略转移时的平衡步骤。
4.某些抗原和抗体可被Tween-20 洗脱,此时可用1.0% BSA代替Tween-20。
5.关于封闭剂的选择:5%脱脂奶/TBS or PBS: 能和某些抗原相互作用,掩盖抗体结合能力;0.3~3% BSA in PBS:低的内源性交叉反应性。
6.如用0. 1% Tween 20、0.02% NaN3 in PBS or TBS作封闭剂和抗体稀释液,抗体检测后可进行蛋白染色。
7.如要同时检测大分子量和小分子蛋白,最好用梯度胶分离蛋白。
上一篇:流式细胞仪常用的几种检测方法
下一篇: PVDF 膜上蛋白的可逆染色

微信扫码在线客服