AAT Bioquest的iFluor?染料经过优化,特别适合标记蛋白质,尤其是抗体。这些染料亮度高、光稳定性好,并且在蛋白质上几乎不发生猝灭。它们可以被荧光仪器的主要激光线很好地激发(例如,350、405、488、555和633纳米)。iFluor? 350染料的荧光激发和发射最大值分别约为345纳米和450纳米。这些光谱特性使它们成为AMCA和Alexa Fluor? 350标记染料(Alexa Fluor?是Invitrogen的商标)的极佳替代品。iFluor? 350马来酰亚胺的稳定性合理,并且对巯基具有良好的反应性和选择性。
艾美捷iFluor 350马来酰亚胺:
货号:AAT-1060
单位大小:1 毫克
分子量:355.34
溶剂:DMSO
校正因子(260 纳米):0.83
校正因子(280 纳米):0.23
消光系数(cm -1 M -1):200001
激发(纳米):345
发射(纳米):450
量子产率:0.951
H-短语:H303, H313, H333
危险符号:XN
预期用途:仅限研究使用(RUO)
R-短语:R20, R21, R22
储存:冷冻(< -15 °C);尽量减少光照暴露
库存溶液的准备:
除非另有说明,所有未使用的库存溶液应在制备后分成单次使用的小份,并储存在 -20 °C。避免反复冻融循环。
iFluor? 350 马来酰亚胺库存溶液(溶液 B):
向iFluor? 350 马来酰亚胺的瓶中加入无水DMSO,制成10 mM的库存溶液。通过移液或涡旋混合均匀。
注意:在开始偶联之前准备染料库存溶液(溶液 B)。请立即使用。延长染料库存溶液的储存可能会降低染料活性。溶液 B 可以在避光和防潮的情况下在冷冻库中储存长达4周。避免冻融循环。
蛋白质库存溶液(溶液 A):
将100 ?L的反应缓冲液(例如,pH约6.0的100 mM MES缓冲液)与900 ?L的目标蛋白质溶液(例如,抗体,蛋白质浓度尽可能大于2 mg/mL)混合,得到1 mL的蛋白质标记库存溶液。
注意:蛋白质溶液(溶液 A)的pH值应为6.5 ± 0.5。
注意:不纯的抗体或用牛血清白蛋白(BSA)或其他蛋白质稳定的抗体不会被很好地标记。
注意:如果蛋白质浓度低于2 mg/mL,偶联效率将显著降低。为了获得最佳的标记效率,建议最终蛋白质浓度范围在2-10 mg/mL之间。
可选:如果您的蛋白质不含有游离的半胱氨酸,您必须用DTT或TCEP处理您的蛋白质以生成巯基。DTT或TCEP用于将二硫键转换为两个游离的巯基。如果使用DTT,您必须在将染料马来酰亚胺偶联到您的蛋白质之前,通过透析或凝胶过滤去除游离的DTT。以下是生成游离巯基的示例协议:
用蒸馏水准备新鲜的1 M DTT溶液(15.4 mg/100 ?L)。
在20 mM DTT中制备IgG溶液:每毫升IgG溶液中加入20 ?L的DTT库存,同时混合。在室温下静置30分钟,无需额外混合(以最小化半胱氨酸重新氧化为胱氨酸)。
将还原的IgG通过预平衡的“交换缓冲液”的过滤柱。收集柱上的0.25 mL分数。
测定蛋白质浓度,并汇集含有大部分IgG的分数。这可以通过分光光度法或比色法完成。
在此步骤后尽快进行偶联(见样品实验协议)。
注意:IgG溶液应大于4 mg/mL以获得最佳结果。如果抗体浓度低于2 mg/mL,则应浓缩抗体。在缓冲液交换柱上损失额外的10%。
注意:还原可以在几乎任何pH 7-7.5的缓冲液中进行,例如MES、磷酸盐或TRIS缓冲液。
注意:步骤3和4可以被透析替代。
样品实验协议:
这个标记协议是为山羊抗小鼠IgG与iFluor? 350 马来酰亚胺的偶联而开发的。您可能需要针对您的特定蛋白质进行进一步优化。
注意:每种蛋白质都需要不同的染料/蛋白质比例,这也取决于染料的性质。过度标记蛋白质可能会对其结合亲和力产生不利影响,而染料/蛋白质比例过低的蛋白质偶联物则灵敏度降低。
运行偶联反应:
使用10:1的溶液B(染料)/溶液A(蛋白质)的摩尔比例作为起点:将5 ?L的染料库存溶液(溶液B,假设染料库存溶液为10 mM)加入到蛋白质溶液(95 ?L的溶液A)的瓶中,并有效摇动。假设蛋白质浓度为10 mg/mL,蛋白质分子量约为200KD,蛋白质的浓度约为0.05 mM。
注意:我们建议使用10:1的溶液B(染料)/溶液A(蛋白质)的摩尔比例。如果太低或太高,请分别确定5:1、15:1和20:1的最佳染料/蛋白质比例。
继续在室温下旋转或摇动反应混合物30-60分钟。
纯化偶联物:
以下是一个使用Sephadex G-25柱纯化染料-蛋白质偶联物的示例协议。
根据制造商的说明准备Sephadex G-25柱。
将反应混合物(来自“运行偶联反应”)加载到Sephadex G-25柱的顶部。
当样品刚刚低于顶部树脂表面时,立即添加PBS(pH 7.2-7.4)。
添加更多的PBS(pH 7.2-7.4)以完成所需的样品柱纯化。合并包含所需染料-蛋白质偶联物的分数。
注意:如果立即使用,染料-蛋白质偶联物需要用染色缓冲液稀释,并分装多次使用。
注意:对于长期储存,染料-蛋白质偶联物溶液需要浓缩或冷冻干燥。
表征所需的染料-蛋白质偶联物:
取代度(DOS)是表征染料标记蛋白质的最重要因素。较低DOS的蛋白质通常具有较弱的荧光强度,但较高DOS的蛋白质也倾向于降低荧光。对于大多数抗体,推荐的最优DOS在2到10之间,具体取决于染料和蛋白质的性质。为了有效标记,应控制取代度,使每摩尔抗体有5-8摩尔的iFluor? 350 马来酰亚胺。以下步骤用于确定iFluor? 350 马来酰亚胺标记蛋白质的DOS。
测量吸收:
为了测量染料-蛋白质偶联物的吸收光谱,建议保持样品浓度在1-10 ?M范围内,具体取决于染料的消光系数。
读取OD(吸光度)在280纳米和染料最大吸收(λmax = 345纳米,对于iFluor? 350染料)
对于大多数分光光度计,需要将样品(来自柱分数)用去离子水稀释,以便OD值在0.1到0.9的范围内。280纳米的O.D.(吸光度)是蛋白质的最大吸收,而345纳米是iFluor? 350 马来酰亚胺的最大吸收。为了获得准确的DOS,请确保偶联物中不含未偶联的染料。
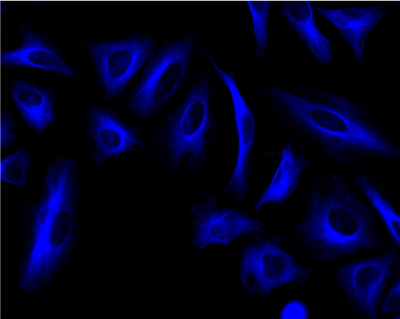
图:HeLa细胞用小鼠抗微管蛋白染色,然后用iFluor 350山羊抗小鼠IgG(H+L)染色。

微信扫码在线客服