染色质免疫共沉淀是一种强力的手段,来联系蛋白质或其修饰位点与基因组的关系。染色质分离并用特异性抗体判断是否与特异性DNA 序列相结合。染色质免疫沉淀法亦可用来检测目的位点在基因组中的时空分布(用芯片或DNA 测序)。本操作规程详细阐述了交联染色质免疫沉淀(X-ChIP) 实验的具体步骤。

此方法涉及抗IgM 抗体的IgG 耦联蛋白A 或G 珠子(方法见下文)。这些珠子就可以在常规免疫共沉淀程序中使用IgM 抗体。通过结合抗-IgM 抗体,IgM 可以间接结合珠子。

为了使洗脱蛋白较少污染抗体,也为了更纯净蛋白质的制备和干净的免疫印迹实验,推荐将抗体与珠子交联。下面是一个实验程序举例(几个网站有关于这个程序有很多信息)。目标蛋白应该用温和的洗脱液洗脱,如甘氨酸缓冲液。

为了使洗脱蛋白较少污染抗体,也为了更纯净蛋白质的制备和干净的免疫印迹实验,推荐将抗体与珠子交联。下面是一个实验程序举例(几个网站有关于这个程序有很多信息)。目标蛋白应该用温和的洗脱液洗脱,如甘氨酸缓冲液。更详细的缓冲液配方可在缓冲液章节找到,第71页。

裂解物预清除可以帮助减少蛋白质非特异性结合到agarose (琼脂糖)或Sepharose beads (凝胶琼脂糖珠)。用无关抗体或血清预清除,可去除蛋白质与免疫球蛋白的非特异结合。最终实验结果背景降低并且信噪比提高。但是,如果最后蛋白质是由免疫印迹实验检测,预清除未必必要,除非是污染蛋白质对目的蛋白质产生明显干扰。

免疫沉淀是一种纯化蛋白质的方法。将我们感兴趣的一种蛋白质的抗体与细胞提取液孵育,以使抗体和蛋白质在溶液中结合。然后用蛋白A/G 耦合的琼脂糖凝胶,从样品中将抗体/抗原复合物提取出来。这种物理方法可将所需蛋白质从样品中分离出来。然后样品可以通过SDS-PAGE 分离出来进行Western blot 分析。

直接免疫荧光染色时,细胞与直接偶联有荧光染料(如 FITC 标记)的抗体孵育。这种方法的优点在于只需要一步抗体孵育,从而排除了二 抗非特异性结合的可能性。这对细胞内染色特别有用,因为包含二抗的大抗体荧光复合物有可能被困住,造成非特异性结合甚或无法进入细胞,而使一抗检测不到。

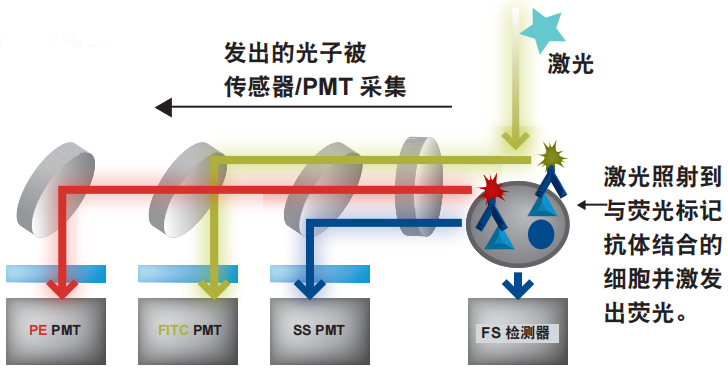
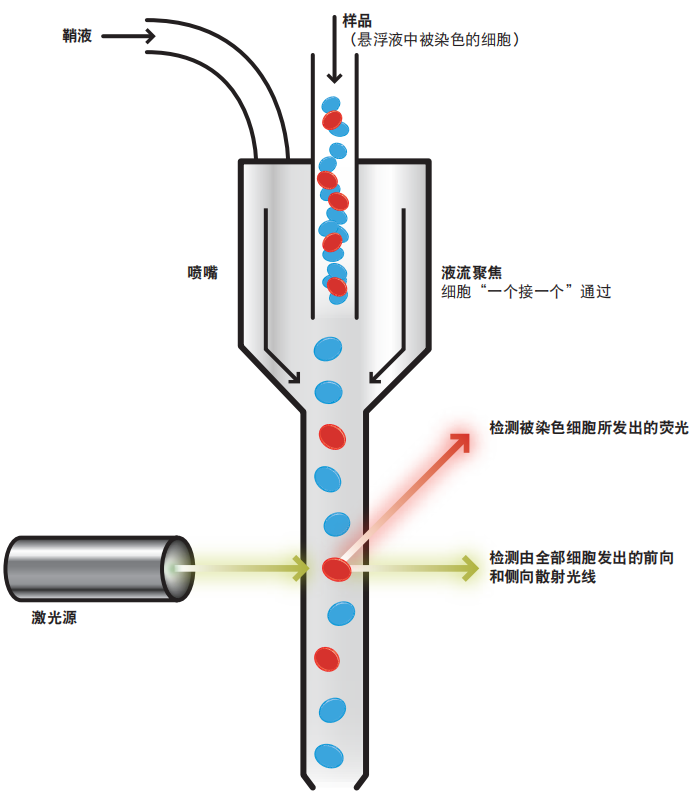
悬浮缓冲液中被染色细胞样品通过流式细胞仪时,由于鞘液的作用,细胞被限制在液流的轴线上,从而能通过一个非常小的喷嘴。这种微小 的“流液束”使细胞一个接一个地通过激光。

用 PBS 或碳酸盐缓冲液稀释抗原至终浓度 20μg/ml。用吸管吸取 50μl 稀释抗原到 PVC 微孔板上,按要求往后进行系列稀释。


微信扫码在线客服