肥大细胞(Mast Cell)广泛分布于皮肤及内脏粘膜下的微血管周围。分泌多种细胞因子,参与免疫调节(TB细胞,APC细胞活化)。表达MHC分子,B7分子,具有APC功能,也表达大量的IgE Fc 受体,释放过敏介质。具有弱的吞噬功能。和血液的嗜碱粒细胞同样为具有强嗜碱性颗粒的组织细胞。
MCs是来源于骨髓多能干造血细胞的先天免疫细胞,在血液中循环并迁移到外周组织,在组织特异性趋化因子和细胞因子(如干细胞因子和IL-4)、细胞外基质蛋白和粘附分子的作用下发育并分化为成熟肥大细胞。MC分布在身体的不同区域,如上皮细胞、粘膜、胃肠道、产生粘液的腺体以及神经和血管周围区域。
在MC表面有多种受体,一旦被它们的配体触发,可以释放各种不同的因子。这些包括预先形成的分子(组胺、类胰蛋白酶、蛋白酶和蛋白多糖)和新合成的脂质介质(白三烯和前列腺素)、细胞因子(IL-4、TNFα、TGF-β、IL-1β)和趋化因子(IL-18、CCL2、CCL4)。预先形成的介质沉淀在MC细胞质中的大颗粒中。每个MC被赋予大约50-200个颗粒,在适当的刺激下,这些颗粒在几秒钟内被输送到细胞外。这个过程被称为MC脱颗粒。
肥大细胞存在两种类型的脱颗粒:过敏性脱颗粒,其中整个颗粒内容物迅速释放到细胞外环境;以及分段脱颗粒,颗粒内容物以更有层次,更具体的方式释放。研究最充分的肥大细胞脱颗粒发生机制是暴露于同源抗原后,高亲和力IgE表面受体FcεRI的抗原特异性IgE交联,导致肥大细胞快速脱颗粒。肥大细胞也可以通过其他机制激活,如通过toll样受体、补体蛋白、细胞因子和其他刺激物的损伤相关和病原体相关分子模式。
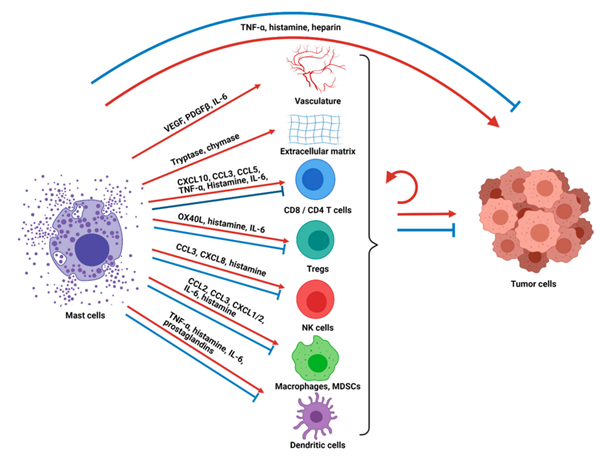
肥大细胞激活、脱颗粒和/或炎症介质分泌的结果包括其他免疫、基质、神经和上皮细胞的激活或吸引,从而导致局部组织微环境的变化,如血管扩张和血管生成,以及全身免疫反应的激活。肥大细胞活化和/或脱颗粒可能以经典的快速方式发生,导致炎症介质的大量释放和剧烈的临床表现,如过敏反应和血管性水肿。然而,随着特定介质的缓慢释放,这些过程也会逐渐发生,导致慢性炎症和局部组织改变。后一种形式的肥大细胞激活在癌症中尤其重要。
MC在癌症相关领域得到了越来越多的关注。然而,它们的作用具有两面性,在不同的情况下促进或抑制肿瘤的发展。
MCs的促肿瘤功能
MC可以支持血管生成、炎症和体内平衡,从而支持癌症的发展。MC还释放类胰蛋白酶和糜蛋白酶等蛋白酶,可激活基质金属蛋白酶,降解细胞外基质和肿瘤周围组织,从而促进肿瘤生长、血管生成和转移。此外,MC释放VEGF、PDGF-β和IL-6,促进血管形成、细胞增殖和肿瘤生长。在胰腺癌患者中,MC在肿瘤病灶内的积聚与预后不良相关。在Myc诱导的β细胞胰腺癌小鼠模型中,当MC脱颗粒受到化学抑制时,肿瘤发展和血管生成减少。
MCs的抗肿瘤功能
肥大细胞在调节肿瘤进展中的一个关键作用是其作为前哨免疫细胞的作用,其释放趋化因子、细胞因子和其他因子,将其他免疫细胞招募到肿瘤微环境中并改变其功能。肥大细胞释放趋化因子,如CXCL10、CLL3和CCL5,它们将CD8+T细胞和CD4+T细胞招募到肿瘤中,它们可以通过TNF-α分泌进一步调节T细胞活性。肥大细胞分泌的组胺有利于特定的辅助性T细胞亚型或T细胞调节反应,这取决于受刺激的受体。活化的肥大细胞也被证明可以上调MHC-II和共刺激分子,作为T细胞的局部抗原呈递细胞发挥作用。
总之,肿瘤、基质和免疫微环境中肥大细胞诱导的抗肿瘤和促肿瘤信号的净平衡决定了肿瘤相关肥大细胞如何影响最终肿瘤生长。正确理解这些因素是如何相互作用的,对于研究相关的肥大细胞生物学以及如何将肥大细胞作为改善癌症预后的最佳治疗选择具有重要意义。
MCs还可以调节TME中其他免疫细胞的功能,从而影响局部免疫抑制或抗肿瘤免疫。例如,在小鼠肝癌模型中,已经表明活化的MCs可以通过CCL2/CCR2轴促进髓源性抑制细胞(MDSCs)的浸润及其IL-17的产生,从而在肿瘤部位募集Tregs。此外,MC可以通过CD40L/CD40轴的直接相互作用增加MDSCs的抑制活性。MCs上的CD40L也可以促进产生IL-10的调节性B细胞(Breg)的扩增。
另一方面,在结直肠癌中,MC可以切换Tregs的功能,Tregs下调IL-10并开始产生IL-17,从而获得促炎症表型。值得注意的是,MC介导的Tregs和效应T细胞向Th17的偏斜依赖于OX40L/OX40轴和IL-6产生之间的串扰。此外,MC衍生的TNF-α对T细胞活化也很重要。MCs产生骨桥蛋白和表达共刺激分子也促进了CD8+T细胞的活化和增殖。MCs可以通过释放白三烯B4影响效应CD8+T细胞向炎症部位的归巢。在小鼠黑色素瘤模型中,还观察到TLR2激活的MC可以通过分泌高剂量的CCL3来募集NK细胞。除CCL3外,MC分泌的其他因子,如IL-4、IL-12和TNF-α,也能够激活NK细胞。
上述相互矛盾的结果表明,根据癌症的分期、癌周或癌内定位以及与TME其他细胞的串扰,MC及其介质可能具有不同的作用。
由于MC可以根据肿瘤类型、定位和从周围微环境接收的信号发挥促肿瘤或抑肿瘤活性,因此治疗策略可以根据环境来消除或促进MC功能。
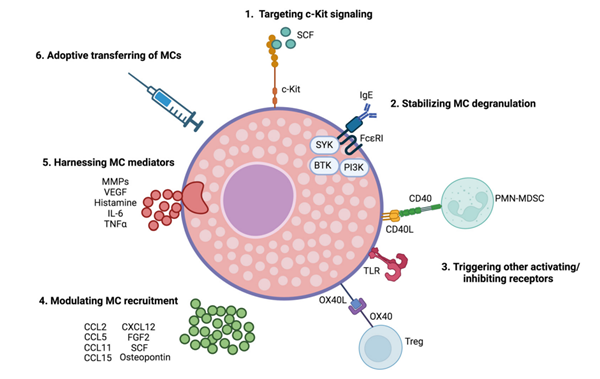
靶向c-Kit信号
由于c-Kit对MC的发育、存活和激活至关重要,因此酪氨酸激酶抑制剂,如伊马替尼、尼洛替尼或达沙替尼,可有效用于靶向肥大细胞增多症、关节炎或过敏反应中的MC。然而,到目前为止,这些药物在抑制MC肿瘤促进功能方面的应用有限。
需要强调的是,伊马替尼、尼洛替尼或达沙替尼对c-Kit没有特异性,因为它们也靶向其他激酶受体,如PDGFR、Src和Abl激酶,因此可能具有脱靶作用。为了克服这些限制,已经开发了一种靶向c-Kit的单克隆抗体,barzolvolimab,但迄今为止仅在c-Kit阳性胃肠道肿瘤中进行了测试。
稳定MC脱颗粒
可以抑制MC脱颗粒的药物,如色甘酸或酮替芬,已被广泛用于治疗过敏反应;其也在实体瘤的不同临床前模型中进行了研究。在甲状腺癌的异种移植小鼠模型中,用色甘酸治疗可显著降低肿瘤细胞的增殖和生长。
除了稳定和阻止肥大细胞介质的释放,也可以选择肥大细胞的上游信号通路作为靶点。IgE与FcεRI结合导致FcεRI聚集,然后导致受体酪氨酸激活基序的下游磷酸化,最终释放炎性介质。从肥大细胞诱导的炎症有利于诱导抗肿瘤反应的角度出发,提出了抗肿瘤IgE抗体。尤其是在肥大细胞浸润率高的肿瘤中,与IgG抗体相比,FcεRI的高密度和抗体的更长半衰期使其成为一种有吸引力的治疗方法。在体外研究中,通过肿瘤靶向的人源化单克隆抗HER-2/neu IgE和人源化抗CD20 IgE观察到抗肿瘤肥大细胞脱颗粒和肿瘤细胞生长减少。
触发其他激活/抑制受体
除了c-Kit和FcεRI外,MC还有大量不同的受体可以调节其在TME中的功能;因此,这些受体可能成为MC特异性抗癌治疗的靶点。
MCs中TLRs的刺激可导致特异性细胞因子分泌,从而导致免疫细胞的募集和激活,最终抑制肿瘤生长。事实上,目前正在评估TLR激动剂在癌症治疗中的作用。在B16.F10小鼠黑色素瘤模型中,TLR2激动剂Pam3CSK4诱导MCs释放细胞因子,如IL-6和CCL3,这分别介导了对肿瘤细胞的直接抗增殖作用以及NK和T细胞的募集。
其他受体也被证明对MC与免疫抑制细胞的相互作用至关重要,例如CD40L和OX40L。MC还可以通过其表面的PD-L1直接抑制CD8+T细胞活化。因此,MCs可能是肿瘤中免疫检查点阻断治疗的另一个靶点。在胃癌模型中,MC相关PD-L1的抑制导致T细胞活化增加和肿瘤生长的抑制。
调节MC招募
靶向MC治疗一种可能的策略是通过作用于趋化途径来抑制或增加其募集。除了调节MC成熟、增殖和脱颗粒外,SCF/c-Kit和FcεRI信号传导也可以介导MC迁移。因此,c-Kit、BTK、Syk和PI3K的抑制剂也可以抑制肿瘤中的MC运输。
此外,由肿瘤细胞或TME细胞产生的许多其他不同分子可以诱导MC趋化性,包括CCL2、CCL5、CCL11、CCL15、CXCL12、VEGF、FGF2、骨桥蛋白和脂质介质。阻断这些趋化引诱剂可能代表一种治疗策略,以阻碍MC的募集,从而阻碍它们对肿瘤的支持。
靶向MC调解剂
直接调节肥大细胞介质是改变肥大细胞下游活化的有效方法,包括靶向组胺或组胺受体、类胰蛋白酶等蛋白酶和TNF-α。
类胰蛋白酶是肥大细胞活化过程中释放的一种肥大细胞介质,促进血管生成和细胞外基质降解,导致癌症生长、细胞侵袭和转移。Tranilast, nafamostat mesylate和gabexatemesylate是三种肥大细胞类胰蛋白酶抑制剂,临床前已证明其作为单一疗法或与其他癌症疗法联合使用在多种实体瘤中具有抗癌活性,大多数研究集中在胰腺癌、结直肠癌和乳腺癌。
TNF-α是另一种肥大细胞介质,长期以来一直与炎症性肠病的发病机制有关,TNF-α抑制剂(如infliximab)是主要的治疗手段。在一项结肠炎研究中,infliximab治疗可显著降低结直肠癌的发病率。在晚期黑色素瘤的I期临床试验(NCT03293784)中,正在研究ipilimumab、nivolumab和TNF-α抗体(infliximab或certolizumab)的三重组合的安全性。
过继转移MC
人们也已经开始研究MC的体内过继转移,利用MC的抗肿瘤特性进行细胞治疗以对抗癌症。这种方法应考虑重新编程MCs,以便仅在与肿瘤细胞接触时释放抗肿瘤介质,以避免非靶向的分子递送、过敏反应或其他副作用。Fereyoduni等人在这方面进行了首次尝试,他们利用HER2/neu特异性IgE预敏化的MC在体外和体内有效杀死乳腺癌症模型中HER2/neu表达的肿瘤细胞。
下一篇:苦味感受器新的探索方向

微信扫码在线客服