描述
TRα-GAL4荧光素酶报告基因HEK293细胞系是一种表达萤火虫荧光素酶的HEK293细胞系,该荧光素酶受GAL4上游激活序列(UAS)的控制,同时稳定表达与GAL4的DNA结合域(DBD)融合的人甲状腺受体α配体结合域。该系统允许特异性检测甲状腺激素诱导的甲状腺受体α的激活,与其他核受体的交叉反应性低。该细胞系已通过三碘甲状腺原氨酸(T-3)的刺激进行了验证。
背景
甲状腺激素对于调节身体的新陈代谢、整体生长和发育至关重要。这些激素通过核受体TRα和TRβ发挥作用,它们分别由THRA和THRB基因编码。甲状腺激素受体作为依赖配体的转录因子,通过与共激活因子、共抑制因子以及其他一般转录因子的相互作用来调节目标基因的产生。TRα在人体中的表达不同,广泛存在于中枢神经系统、心脏、骨骼肌和消化道,而TRβ在肝脏、肾脏、垂体和下丘脑中表达。研究发现,THRA基因中的多种突变与对甲状腺激素α的抵抗和组织特异性甲状腺功能减退症相关。
作为BPS Bioscience在中国的区域总代理,艾美捷科技强烈推荐BPS Bioscience热销产品TRα-GAL4 荧光素酶报告基因 HEK293 细胞系(甲状腺激素受体α通路)。产品仅用于科研,不可用于临床诊断。
| 产品名称 | 货号 | 详情 |
TRα-GAL4 荧光素酶报告基因 HEK293 细胞系(甲状腺激素受体α通路) | BPS-82633 | 查看 |
细胞解冻
1. 在37°C水浴中摇晃冷冻细胞瓶大约60秒。一旦细胞解冻(可能比60秒稍快或稍慢),迅速将瓶中全部内容物转移到含有10毫升预温的解冻培养基1的试管中。
注意:在37°C水浴中放置过久会导致细胞活性迅速丧失。
2. 立即以300 x g的速度离心细胞5分钟,去除培养基,并在5毫升预温的解冻培养基1中重悬细胞。
3. 将重悬的细胞转移到T25或T75培养瓶中,并在37°C的5% CO2培养箱中培养。
4. 培养24小时后,检查细胞附着和活性。更换为新鲜的解冻培养基1,并在37°C的5% CO2培养箱中继续培养,直到细胞准备好传代。
5. 细胞应在完全融合前传代。在第一次传代及后续传代中,使用生长培养基1M。
细胞传代
1. 抽吸培养基,用无Ca2+/Mg2+的磷酸盐缓冲液(PBS)冲洗细胞,并用0.05%胰蛋白酶/EDTA从培养容器中分离细胞。
2. 一旦细胞分离,加入生长培养基1M并转移到试管中。
3. 以300 x g的速度离心细胞5分钟,去除培养基,并在生长培养基1M中重悬细胞。
4. 按照推荐的次培养比例1:6至1:12,每周一次或两次接种到新的培养容器中。
细胞冷冻
1. 抽吸培养基,用无Ca2+/Mg2+的PBS冲洗细胞,并用0.05%胰蛋白酶/EDTA从培养容器中分离细胞。
2. 一旦细胞分离,加入生长培养基1M并计数细胞。
3. 以300 x g的速度离心细胞5分钟,去除培养基,并在4°C的细胞冷冻培养基(BPS Bioscience #79796)中重悬细胞至约2 x 10^6细胞/毫升。
4. 将1毫升的细胞悬浮液分装到每个冷冻小瓶中。将小瓶放置在保温容器中缓慢冷却,并在-80°C下过夜保存。
5. 次日将小瓶转移到液氮中进行长期储存。
注意:建议在早期传代时扩增细胞并至少冷冻10瓶以备将来使用。
数据展示:
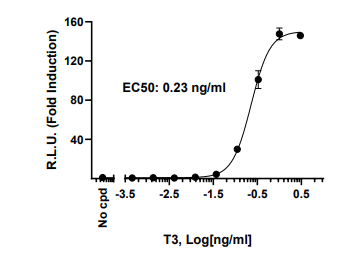
图1.TRα-GAL4荧光素酶报告基因HEK293细胞系对T-3的剂量反应曲线。
TRα-GAL4荧光素酶报告基因HEK293细胞在96孔板格式中用逐渐增加浓度的T-3处理。使用ONE-Step?荧光素酶检测系统测量荧光素酶活性。结果表示为与未经处理的细胞(未刺激对照)活性相比,荧光素酶报告基因表达的倍数诱导。
文献参考:
Bochukova E., et al., 2012 New England Journal of Medicine 366(3): 243-249.
Moran C., et al., 2015 Best Pract Res Clin Endocrinol Metab 29(4):647-57.
BPS Bioscience是一家通过ISO 9001:2015认证的生命科学领域的供应商,公司一直致力于开发药物研发领域的重组蛋白酶、蛋白酶活性/抑制剂筛选试剂盒和慢病毒等工具。公司由Henry Zhu博士于2005年创立,从创立至今一直致力于提供药物研发领域的创新解决方案,以推动新的药物发现。公司主要关注的领域包括免疫疗法、表观遗传学、新型冠状病毒、CRISPR、细胞信号转导等,主要提供激酶、磷酸二酯酶、磷酸酶、组蛋白去甲基化酶、组蛋白甲基化转移酶、HDACs、聚ADP核糖聚合酶等。
作为BPS Bioscience在中国的区域代理,艾美捷科技有限公司将为中国客户提供全面的BPS Bioscience以及客户订制化服务。


微信扫码在线客服